有機化学講座
講座紹介
医薬品や生体を構成する分子のほとんどは有機化合物であり、生体内で生命を維持するために進行している様々な反応も有機化学反応です。生命現象を分子レベルで解明するためには有機化学の知識は必要不可欠です。私たちの研究室では有機化学の知識を基に化学構造式の読める薬剤師の養成を目指しています。
研究内容としては、例えば新しい薬を理論的に開発するためには病気のメカニズムを知る必要がありますが、今日ではこのような目的のために、様々な生命現象を可視化するための蛍光分子(蛍光分子プローブという)が開発され、生命現象を解明するための必要不可欠な手段となっています。私達の研究室では、オワンクラゲから単離された緑色蛍光タンパク質(Green Fluorescent Protein 以下GFP)の蛍光を発する構造(クロモホア構造という)を基に、生態環境の変化等を可視化できる新たな機能性蛍光分子の開発に取り組んでいます(図1)。
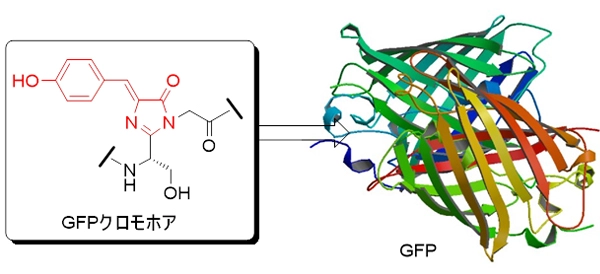
図1 GFPとGFPクロモホアの構造
研究詳細
1)GFPクロモホアをモデルにした新規蛍光分子の開発
1-1)蛍光低分子化合物 DAINの開発研究
GFPは、海洋生物であるオワンクラゲから単離された緑色蛍光タンパク質であり、下村 脩博士は本研究成果により2008年にノーベル化学賞を受賞されています。GFPの蛍光を発するクロモホア構造は図2に示すような構造を持っています。この構造は、タンパク質構造中にある場合にはZ型構造に固定されていますが、その部分構造のみを化学合成し、タンパク質構造と切り離した場合、光照射によって容易にE型に構造変化(光異性化)し、そのZ型は蛍光能を有するのに対し、E型の蛍光能は一般的に低いことが知られています(図2)。
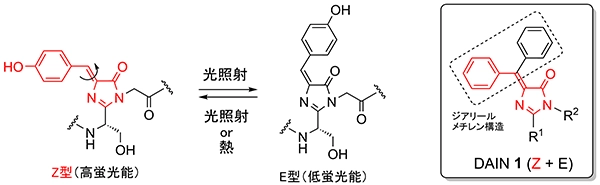
図2 GFPクロモホアの光異性化とDAINの構造
我々は、GFPクロモホア構造を基に、光異性化しても蛍光能が低下しない蛍光分子としてdiarylmethyleneimidazolinone(DAIN)1を考案し、その蛍光分子としての有効性を報告しました。本化合物の特徴は、光異性化しても構造変化しない(蛍光能が低下しない)点に加えて、ジアリールメチレン構造が回転可能な溶液状態では、蛍光を示さないのに対して、回転不可能な状態、すなわち凍結状態や粉末状態では蛍光を示す点にあります。図3に示すように蛍光色や蛍光強度に関しては、分子の構造や分子の会合状態(集まり方)に依存することも明らかになりました。現在、DAIN構造に様々な複素環構造を結合させるなどの修飾を行い、新たな蛍光特性をもつ蛍光分子の開発を行っています。
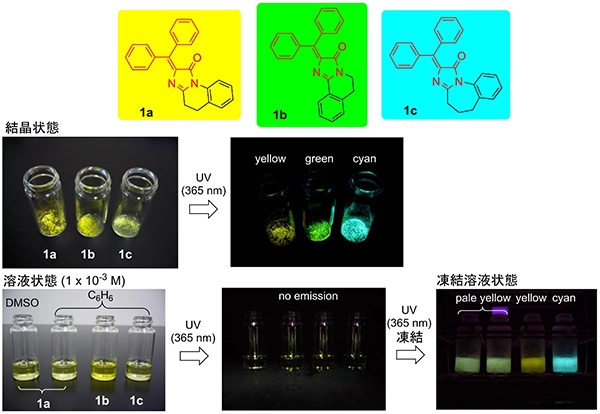
図3 DAIN 1a-cの結晶、溶液および凍結溶液状態の蛍光
1-2)GFP型蛍光低分子化合物 BDIの改良研究
GFPのクロモホア構造は、benzylideneimidazolone (BDI)と呼ばれる骨格を持っており、先に紹介したように、Z型とE型において蛍光のON/OFFの関係にあります。我々はBDI分子の“蛍光ON/OFFスイッチ分子”としての活用を目指し、BDI構造の化学的修飾による改良研究を進めています。
2)DAINの特性を活かしたセンサー分子の開発
DAINのジアリールメチレン構造が回転できる時には無蛍光(Switch OFF)、回転が阻害された時には蛍光を示す(Switch ON)という性質に着目し、DAIN構造を適切な生体分子で修飾することによって様々なセンサー分子の開発につながると考え、以下のような研究を展開しています。
2-1)膜構造の流動性に応答する蛍光分子プローブの開発
ヒトの細胞は脂質二重膜構造を持つ細胞膜で外界から遮られており、薬物がその効果を表すためには細胞膜を通過する必要がありますが、膜機能の詳細は明らかではありません。我々は、DAINを脂質二重膜に取り込ませることによって、脂質二重膜の流動性(粘性)に応じて蛍光強度が変化する“流動性応答型蛍光分子プローブ”の開発につながるものと考え、またそのような蛍光プローブは膜機能解明の一助になると考え本研究に着手しました。すなわちDAIN構造と膜成分の一種であるコレステロールの母核(コレステン骨格)とのハイブリッド構造を持つDAIN 1d, 1eを合成し、人工脂質二重膜中での蛍光強度を測定したところ、膜の流動性に依存して蛍光強度が変化し、流動性応答型蛍光分子プローブとして働くことを明らかにしました(図4)。現在、細胞膜でも適応可能な流動性応答型蛍光分子プローブを開発すべく、さらなる改良を行っています。
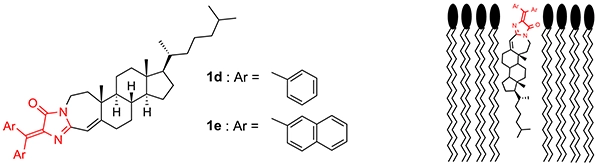
図4 DAIN 1d, 1eの構造と予想される脂質中での配向
2-2)二重鎖DNAの配列を認識する蛍光分子プローブの開発
現在、DNAはPCR(Polymerase Chain Reaction)の手法を用いて増幅させることにより、非常に高感度かつ高精度で分析が可能となっていますが、装置と時間が必要であり、患者のベッドサイドで簡単にできるというものではありません。我々は、DAINが芳香環のつらなった平面性の高い構造を有していることから、二重鎖DNAに取り込まれることによりDAINの構造が固定され蛍光強度が上昇するものと予測し、DNAのリン酸基との親和性も期待できるDAIN 1f を考案しました。DAIN 1fは、二重鎖DNA存在下で特異的に蛍光を発し、時間経過とともにその強度が上昇することを見出しています(図5)。現在は、二重鎖DNAの配列を認識する分子とDAINを組み合わせることにより、PCRによる増幅作業なしで、特定の配列の二重鎖DNAを検出可能な“塩基配列認識型蛍光分子プローブ”の開発を目指して研究を行っています。
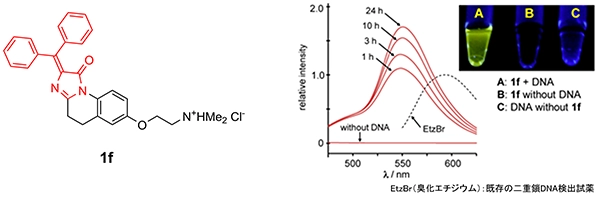
図5 DAIN 1fの構造と二重鎖DNA存在下での蛍光
3)新規複素環合成反応の開発研究
複素環構造は、医薬品をはじめとする様々な機能性分子に必ずと言っていいほど含まれる構造であり、上記のDAIN 1の合成に際しても、我々は独自の方法でその合成を達成してきました。また、DAIN以外にも含フッ素複素環化合物2~4の合成も独自の方法で達成しています(図6)。有機化学的な興味から、様々な複素環構造の合成を独自の方法で達成すべく挑戦しています。
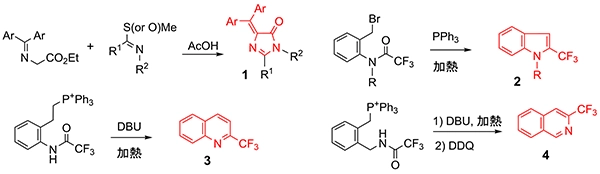
図6 複素環化合物の合成法
主な研究業績
2024年度
- Viscosity-Induced Emission of 5-(Diarylmethylene)imidazolone with Extended Conjugation via Attachment of N-Methylpyrrole at the 2-Position
Masahiro Ikejiri, M.; Yoshimizu, A.; Shiota, F.; Nagayama, A.; Fujisaka, A.; Kuboki, Y.; Miyashita, K.
Chem. Pharm. Bull., 2024, 72, 518–523.
2021年度
- Acetate/Acetic Acid-Assisted One-Pot Synthesis of (Diarylmethylene)imidazolone from Amide or Thioamide Ikejiri, M.; Watanabe, A.; Katsuda, M.; Funakoshi, M.; Fujisaka, A.; Miyashita, K. Heterocycles, 2021, 102, 516-526.
- Synthesis of Trifluoromethyl Derivatives of Quinoline and Isoquinoline Fujisaka, A.; Aomatsu, D.; Kakutani, Y.; Terai, R.; Sakaguchi, K.; Ikejiri, M.; Miyashita, K. Heterocycles, 2022, 104, 573-584.
2019年度
- Synthesis and environment-dependent fluorescence behavior of a biaryl-conjugated (diphenylmethylene)imidazolinone
Ikejiri, M.; Nishiguchi, R.; Kubota, C.; Fujisaka, A.; Miyashita, K.
Org. Biomol. Chem., 2019, 17, 8443–8449.
2018年度
- Synthesis and properties of geometrical 4-diarylmethylene analogs of the green fluorescent protein chromophore
Ikejiri, M.; Kojima, H.; Fugono, Y.; Fujisaka, A.; Chihara, Y.; Miyashita, K.
Org. Biomol. Chem., 2018, 16, 2397–2401.
2017年度
- A hybrid molecule of a GFP chromophore analogue and cholestene as a viscosity-dependent and cholesterol-responsive fluorescent sensor
Ikejiri, M.; Mori, K.; Miyagi, R.; Konishi, R.; Chihara, Y.; Miyashita, K.
Org. Biomol. Chem., 2017, 15, 6948-6958.
- 緑色蛍光タンパク質(GFP)クロモホアをモデルとした新規蛍光分子の開発
池尻昌宏,宮下和之
生産と技術 2017, 69, 50-55.
2016年度
- Synthesis and properties of 4-(diarylmethylene)imidazolinone-conjugated fluorescent nucleic acids
Okuda, T.; Mori, S.; Kasahara, Y.; Morihiro, K.; Ikejiri, M.; Miyashita, K.; Obika, S.
Tetrahedron Lett. 2016, 57, 3129-3132.
2015年度
- Synthesis and fluorescence properties of 4-diarylmethylene analogues of the green fluorescent protein chromophore
Ikejiri, M.; Matsumoto, K.; Hasegawa, H.; Yamaguchi, D.; Tsuchino, M.; Chihara, Y.; Yamaguchi, T.; Mori, K.; Imanishi, T.; Obika, S.; Miyashita, K.
Tetrahedron 2015, 71, 4987-4998.
2014年度以前
- Design and concise cynthesis of a novel type of green fluorescent protein chromophore analogue
Ikejiri, M.; Tsuchino, M.; Chihara, Y.; Yamaguchi, T.; Imanishi, T.; Obika, S.; Miyashita, K.
Org. Lett. 2012, 14, 4406–4409.